Индуцирани плюрипотентни стволови клетки (iPSCs)
Въпреки че плурипотентността може да се прояви естествено само в ембрионалните стволови клетки, е възможно да се индуцират терминално диференцирани клетки, за да станат отново плюрипотентни. Процесът на директно препрограмиране превръща диференцирани соматични клетки в iPSC линии, които могат да формират всички видове клетки в организма. Препрограмирането се фокусира върху експресията на онкогени като Myc и Klf4 (подобен на Круппел фактор 4). Този процес се усилва чрез понижаване на регулацията на гените, стимулиращи стабилността на генома, като p53. Освен това, препрограмирането на клетки включва промяна на хистона. Всички тези процеси могат да причинят потенциален мутагенен риск и по-късно да доведат до увеличен брой мутации. Quinlan et al. проверени напълно плюрипотентни миши iPSC, използвайки алгоритми за откриване на ДНК на цели геноми и структурни вариации (SV). Въз основа на тези проучвания беше потвърдено, че макар да има единични мутации в негенетичния регион, има не-ретротранспонсови вкарвания. Това доведе до заключението, че съвременните методи за препрограмиране могат да произведат напълно плюрипотентни iPSC без тежки геномни изменения. 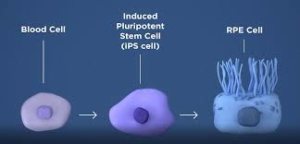
По време на развитието от плюрипотентни hESC до диференцирани соматични клетки се появяват решаващи промени в епигенетичната структура на тези клетки. Има ограничение или разрешение на транскрипцията на гени, свързани с всеки тип клетки. Когато соматичните клетки се препрограмират с помощта на транскрипционни фактори, цялата епигенетична архитектура трябва да бъде възстановена, за да се постигне iPSC с плурипотентност. Клетките на всяка тъкан обаче се подлагат на специфично соматично геномно метилиране. Това влияе на транскрипцията, което може допълнително да причини промени в индуцираната плюрипотентност.
Източник на iPSC
Тъй като плурипотентните клетки могат да се размножават за неопределено време и да се диференцират във всякакъв вид клетки, те могат да бъдат неограничен източник или за заместване на загубени или болни тъкани. iPSCs заобикалят нуждата от ембриони в терапията със стволови клетки. Тъй като са направени от собствените клетки на пациента, те са автоложни и вече не създават риск от имунно отхвърляне.
Отначало фибробластите бяха използвани като източник на iPSC. Тъй като за постигането на тези видове клетки беше необходима биопсия, техниката беше подложена на допълнителни изследвания. Изследователите проучваха дали по- достъпни клетки могат да бъдат използвани в метода. Освен това в процеса са използвани и други клетки: периферни кръвни клетки, кератиноцити и бъбречни епителни клетки, открити в урината. Алтернативна стратегия за трансплантация на стволови клетки може да бъде стимулиране на ендогенните стволови клетки на пациента да се разделят или диференцират, възниквайки естествено, когато раните на кожата заздравяват. През 2008 г. е показано, че екзокринните клетки на панкреаса се препрограмират към функционални, произвеждащи инсулин бета-клетки.
Най- добрият източник на стволови клетки изглежда са фибробластите, което е по- изкушаващо в случая на логистика, тъй като стимулирането му може да бъде бързо и по-добре контролирано.
Тест за формиране на тератома
Възможностите за самообновяване и диференциация на iPSCs придобиха значителен интерес и внимание в науките за регенеративна медицина. За да се изучат техните способности, е необходим анализ за контрол на качеството, от които един от най-важните е анализът на образуването на тератома. Тератомите са доброкачествени тумори. Тератомите са способни на бърз растеж in vivo и са характерни поради способността си да се развиват в тъкани и на трите зародишни слоя едновременно. Поради високата плурипотентност на тератомите, този анализ се счита за оценка на способностите на iPSC . 
Наблюдава се например, че степента на образуване на тератома е повишена в човешки iPSC в сравнение с тази в hESC. Тази разлика може да бъде свързана с различни методи за диференциация и произход на клетките. Най-често анализът на тератома включва инжектиране на изследвани iPSC подкожно или под тестиса или бъбречната капсула при мишки, които са имунодефицитни. След инжектиране може да се наблюдава незряла, но разпознаваема тъкан, като бъбречните тубули, костите, хрущялите или невроепителия. Мястото на инжектиране може да окаже влияние върху ефективността на образуването на тератома.
Има три групи маркери, използвани в този анализ за диференциране на клетките на зародишните слоеве. За ендодермалната тъкан има инсулин / С-пептид и алфа-1 антитрипсин . За мезодермата могат да се използват производни, напр. хрущялен матричен протеин за костта и алхиево синьо за хрущяла. Като ектодермални маркери, за кератиноцити могат да се използват ботулин или кератин от клас III В.
Тестовете за формиране на тератома се считат за златен стандарт за демонстриране на плюрипотентността на човешките iPSC, демонстрирайки техните възможности при физиологични условия. Поради действителното им образуване на тъкани, те биха могли да се използват за характеризиране на много клетъчни родове.
Насочена диференциация
За да бъдат полезни в терапията, стволовите клетки трябва да бъдат превърнати в желани типове клетки, ако е необходимо, в противен случай целият процес на регенеративно лекарство ще бъде безсмислен. Диференцирането на ESC е от решаващо значение, тъй като недиференцираните ESC могат да причинят образуване на тератома in vivo. Разбирането и използването на сигнални пътища за диференциране е важен метод за успешна регенеративна медицина. При насочена диференциация е възможно да се имитират сигнали, които се получават от клетките, когато преминат последователни етапи на развитие.  Извънклетъчната микросреда играе значителна роля за контролиране на поведението на клетките. Чрез манипулиране на културните условия е възможно да се ограничат специфичните пътища за диференциация и да се генерират култури, обогатени в определени прекурсори in vitro. Обаче постигането на подобен ефект in vivo е предизвикателство. Важно е да се развият културни условия, които ще позволят насърчаването на хомогенна и засилена диференциация на ESC във функционални и желани тъкани.
Извънклетъчната микросреда играе значителна роля за контролиране на поведението на клетките. Чрез манипулиране на културните условия е възможно да се ограничат специфичните пътища за диференциация и да се генерират култури, обогатени в определени прекурсори in vitro. Обаче постигането на подобен ефект in vivo е предизвикателство. Важно е да се развият културни условия, които ще позволят насърчаването на хомогенна и засилена диференциация на ESC във функционални и желани тъкани.
По отношение на самообновяването на ембрионалните стволови клетки, Hwang et al. отбелязват, че идеалният културен метод за терапия на клетки и тъкани на базата на hESC би бил определена култура, свободна или от подхранващия слой, или от животински компоненти. Това е така, защото клетъчната и тъканната терапия изисква поддържането на големи количества недиференцирани hESC, което не прави захранващите клетки подходящи за такива задачи.
Повечето насочени протоколи за диференциация се формират, за да имитират развитието на вътрешна клетъчна маса по време на гаструлация. По време на този процес плюрипотентните стволови клетки се диференцират в ектодермални, мезодермални или ендодермални прогенитори. Молекулните молекули или растежните фактори индуцират превръщането на стволовите клетки в подходящи прогениторни клетки, което по- късно ще доведе до желания тип клетки. Съществуват различни интензивности на сигнала и молекулни семейства, които могат да повлияят на установяването на зародишни слоеве in vivo, като фактори на растеж на фибробластите . Всеки кандидат фактор трябва да бъде тестван на различни концентрации и допълнително да се прилага за различни продължителности, тъй като точните концентрации и времето, през които развиващите се клетки в ембрионите се влияят по време на диференциацията, са неизвестни.
Съществуват многобройни протоколи за методите за образуване на прародители на клетки от всеки от зародишните слоеве, като кардиомиоцити, хепатоцити, бъбречни клетки, белодробни клетки ,моторни  неврони , чревни клетким или хондроцити .
неврони , чревни клетким или хондроцити .
Насочено диференциране на iPSC или ESC в напр. хепатоцитите, могат да повлияят и развият изследването на молекулните механизми в развитието на черния дроб на човека. В допълнение, той би могъл също да предостави възможност за образуване на екзогенни хепатоцити за тестване на лекарствената токсичност.
Нивата на концентрация и продължителността на действие със специфична сигнална молекула могат да причинят различни фактори. За съжаление, за сега, високата цена на рекомбинантните фактори вероятно ще ограничи използването им в по- голям мащаб в медицината. По- обещаващата техника се фокусира върху използването на малки молекули. Те могат да бъдат използвани за активиране или деактивиране на специфични сигнални пътища. Те повишават ефективността на препрограмирането, като създават клетки, които са съвместими с желания тип тъкан. Това е по-евтин и неимуногенен метод.
Един от успешните примери за маломолекулни клетъчни терапии са антагонисти и агонисти на пътя на таралеж. Те показват, че са много полезни при регенерацията на моторните неврони. Ендогенни малки молекули с тяхната функция в ембрионалното развитие също могат да бъдат използвани в in vitro методи за предизвикване на диференциация на клетките; например, ретиноевата киселина, която е отговорна за моделирането на нервната система in vivo, изненадващо индуцира образуването на клетки на ретината, когато лабораторната процедура включва hESC.
Ефикасността на факторите на диференциация зависи от функционалната зрялост, ефективността и накрая, въвеждането на произведените клетки в техния in vivo еквивалент. Топографията, напрежението на срязване и твърдостта на субстрата са фактори, влияещи върху фенотипа на бъдещите клетки. 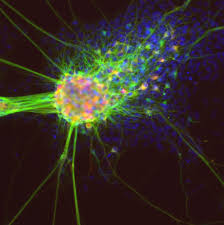
Контролът на биофизичните и биохимичните сигнали, биофизичната среда и правилното ръководство за диференциране на hESC са важни фактори за подходящо култивирани стволови клетки.
Използване на стволови клетки и техните производствени стандарти и културни системи
Европейската агенция по лекарствата и Администрацията по храните и лекарствата са определили насоки за добра производствена практика (Good Manufacturing Practice – GMP) за безопасна и подходяща трансплантация на стволови клетки. В миналото протоколи, използвани за трансплантация на стволови клетки, изискват продукти от животински произход.
Рискът от въвеждане на животински антигени или патогени предизвика ограничение при тяхната употреба. Поради такива ограничения техниката изисква очевидна актуализация. Сега е от съществено значение да се използват без ксенонови еквиваленти при установяване на клетъчни линии, които са получени от свежи ембриони и култивирани от човешки хранителни клетъчни линии. При този метод е изключително важно да се заменят всички материали, които не са човешло, с еквиваленти без ксенон. 
NutriStem с LN-511, TeSR2 с човешки рекомбинантен ламинин (LN-511) и RegES с фибробласти на човешка препуциума (HFFs) обикновено се използват системи за култура без ксенон. Има много организации и международни инициативи, например Националната банка за стволови клетки, които предоставят линии за стволови клетки за лечение или медицински изследвания.







